分类
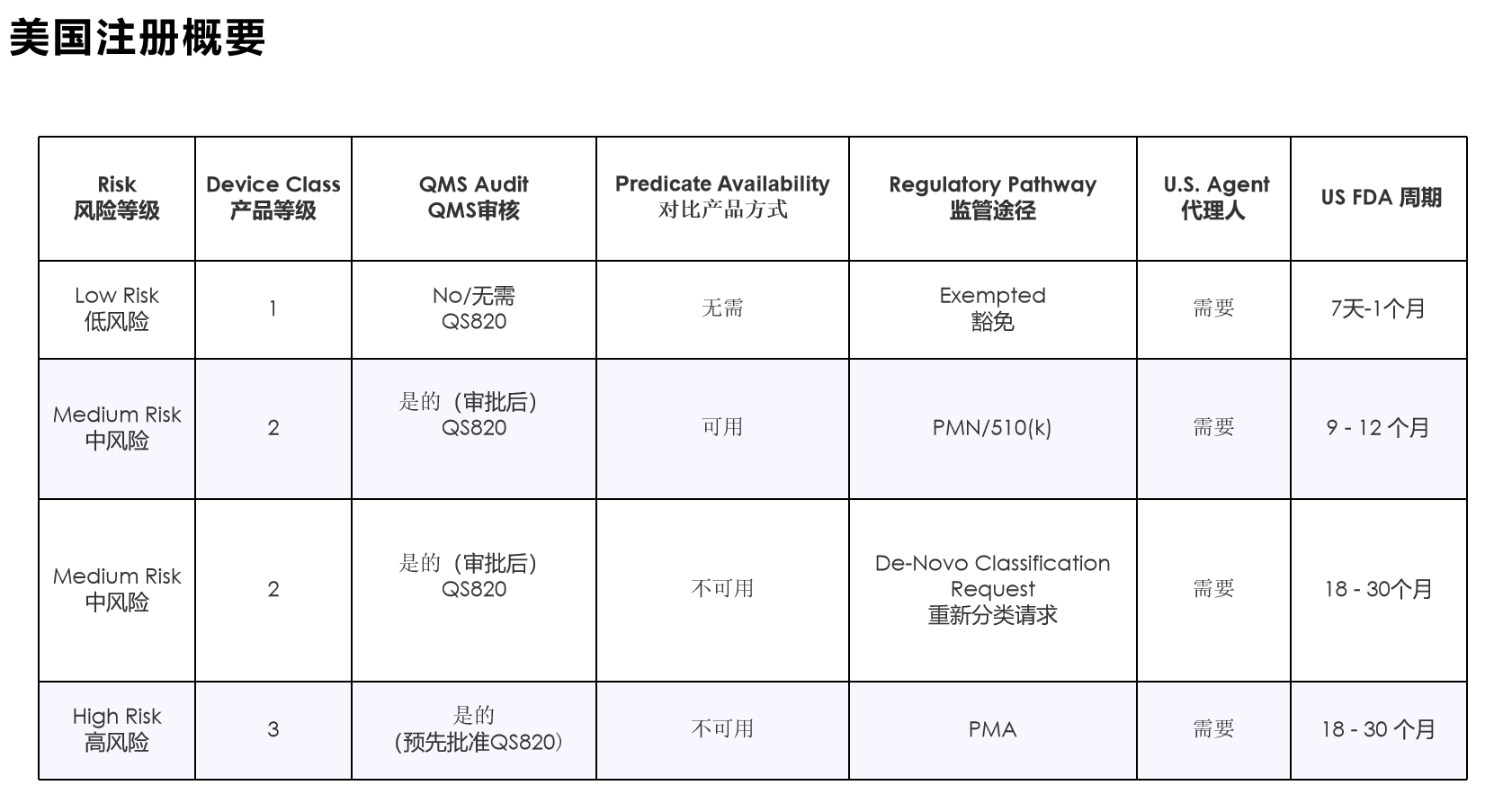
医疗器械分为一类、二类、三类。
设备分类法规定义了一般设备类型的法规要求。大多数 I 类设备不受上市前通知 510(k) 的约束;大多数 II 类设备需要上市前通知 510(k);大多数 III 类设备需要上市前批准。设备分类的描述和产品分类数据库的链接可在“医疗设备分类”中找到。
在美国销售的医疗器械制造商必须遵守的基本监管要求是:
· 公司注册、
· 医疗器械产品列名,
· 上市前通知 510(k),除非获得豁免,或上市前批准(PMA),
· 临床研究的研究设备豁免 (IDE)
· 质量体系(QS)监管,
· 标签要求,以及
· 医疗器械报告
合规流程
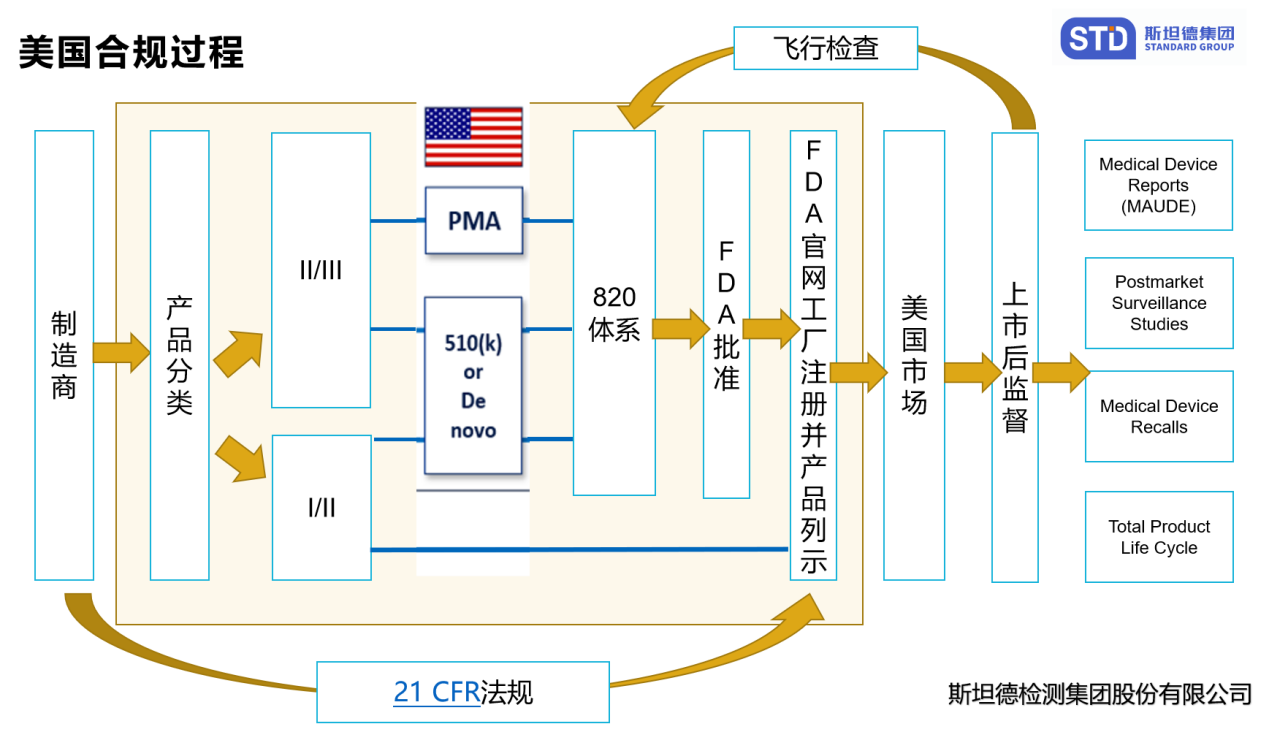
公司注册 - 21 CFR 第 807 部分
医疗器械制造商(国内外)和初始分销商(进口商)必须向 FDA 注册其机构。除非 FDA 授予豁免,否则所有企业注册都必须以电子方式提交。除注册外,外国制造商还必须指定美国代理人。自 2007 年 10 月 1 日起,大多数企业都需要缴纳企业注册费。
医疗器械产品列明 - 21CFR 第 807 部分
制造商必须向 FDA 列出其设备。需要列出其设备的机构包括:
· 制造商,
· 合同制造商,
· 合同灭菌器,
· 重新包装商和重新贴标签商,
· 规范开发人员,
· 洗消一次性设备,
· 再制造商
· 直接销售给最终用户的配件和组件制造商
· “仅限出口”设备的美国制造商
上市前通知 510(k) - 21 CFR 第 807 部分 E 子部分
如果您的设备需要提交上市前通知 510(k),则在您收到 FDA 授权您这样做的实质等效信函之前,您不能对该设备进行商业分销。510(k) 必须证明该设备与在美国合法商业销售的设备实质上等效:
2002 年 10 月 26 日,《2002 年医疗器械使用费和现代化法案》成为法律。它授权 FDA 对医疗器械上市前通知 510(k) 审查收取费用。小企业可以支付较低的费用。申请费适用于传统、简化和特殊 510(k)。上市前审查费的支付与 FDA 对提交的最终决定没有任何关系。
大多数 I 类设备和一些 II 类设备无需提交上市前通知 510(k)。
如果您计划向 FDA 发送 I 类或 II 类设备的 510(k) 申请,您可能会发现由认可的机构进行的 510(k) 审查是有益的。FDA 授权 12 家组织对 670 种器械进行初步审查。根据法律规定,FDA 必须在收到认可人士的建议后 30 天内做出最终决定。请注意,由认可人士进行的 510(k) 审查免收任何 FDA 费用;但是,第三方可能会收取审核费用。
上市前批准 (PMA) - 21 CFR 第 814 部分
需要 PMA 的产品属于 III 类设备,属于高风险设备,会带来重大疾病或伤害风险,或者通过 510(k) 流程发现与 I 类和 II 类谓词实质上不等同的设备。PMA 流程更为复杂,包括提交临床数据以支持设备的索赔。
从 2003 财政年度开始(2002 年 10 月 1 日至 2003 年 9 月 30 日),医疗器械使用费适用于原始 PMA 和某些类型的 PMA 补充剂。小型企业有资格享受减免或减免费用。
研究设备豁免 (IDE) - 21CFR 第 812 部分
研究器械豁免 (IDE) 允许在临床研究中使用研究器械,以收集支持上市前批准 (PMA) 申请或向 FDA 提交上市前通知 510(k) 所需的安全性和有效性数据。使用具有重大风险的设备进行的临床研究必须获得 FDA 和机构审查委员会 (IRB) 的批准才能开始研究。使用风险不重大的设备进行的研究必须在研究开始前获得 IRB 的批准。
质量体系法规(QS 法规)- 21 CFR 第 820 部分
质量体系法规包括与医疗器械的设计、采购、制造、包装、标签、储存、安装和服务所使用的方法、设施和控制相关的要求。生产设施接受 FDA 检查,以确保符合质量体系管理要求。
标签 - 21 CFR 第 801 部分
标签包括设备上的标签以及设备随附的描述性和信息性文献。
医疗器械报告 - 21 CFR 第 803 部分
设备可能导致或导致死亡或严重伤害的事件,必须根据医疗设备报告计划向 FDA 报告。此外,还必须报告某些故障。MDR 法规是 FDA 和制造商识别和监控涉及医疗器械的重大不良事件的机制。监管的目标是及时发现并纠正问题。
总结